肌萎缩侧索硬化症病发机制及检测方式
发表时间:2025-01-14肌萎缩侧索硬化症(ALS)是一种破坏性的神经退行性疾病,它导致大脑和脊髓中控制肌肉的运动神经元逐渐减少。随着这些神经元的丧失,肌肉开始变得虚弱并萎缩,这会逐渐损害个体的活动能力、语言表达、进食以及呼吸,最终可能导致死亡。ALS的病理特征表现为上、下运动神经元合并受损。病理生理学机制的研究对于开发新的ALS治疗药物具有重要意义。

一、病因
肌萎缩侧索硬化症(Amyotrophic Lateral Sclerosis, ALS)的确切病因目前尚未完全明确,但研究表明它可能涉及多种因素,包括遗传因素、环境因素和生活方式等。约10%的ALS患者具有家族遗传史,其中一些已知的关联基因包括SOD1、C9orf72、TARDBP和FUS。这些基因的突变可能导致蛋白质错误折叠和聚集,影响细胞功能,最终导致运动神经元的损伤和死亡。
二、临床症状
ALS的临床表现多样,因为疾病影响的是控制肌肉的运动神经元。ALS的进展通常是快速且不可逆的,症状会随着时间的推移逐渐恶化。典型症状包括肌肉无力与萎缩、痉挛及抽搐、言语和吞咽困难、呼吸问题以及反射改变。患者可能还会经历步态障碍、认知与行为变化(如额颞叶痴呆)、偶尔的感觉异常、情绪波动及疼痛。
三、ALS发病机制
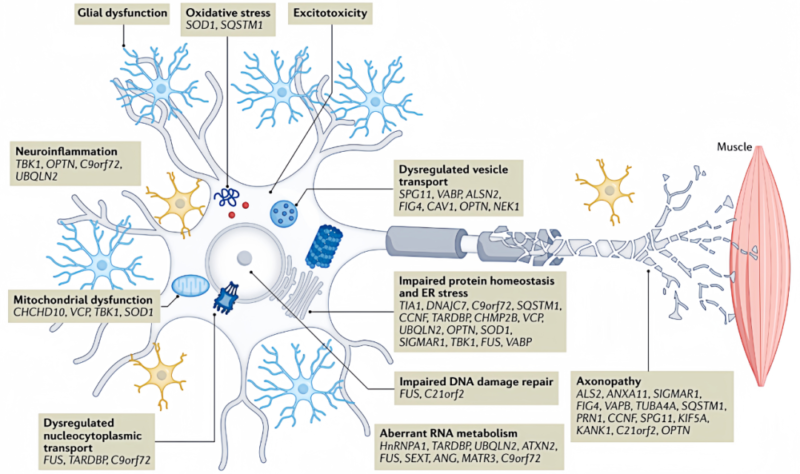
肌萎缩侧索硬化症(ALS)的发病机制涉及遗传、氧化应激、兴奋性毒性、神经炎症、线粒体功能紊乱、DNA和RNA损伤以及蛋白稳态受损等多个方面。
四、遗传结构
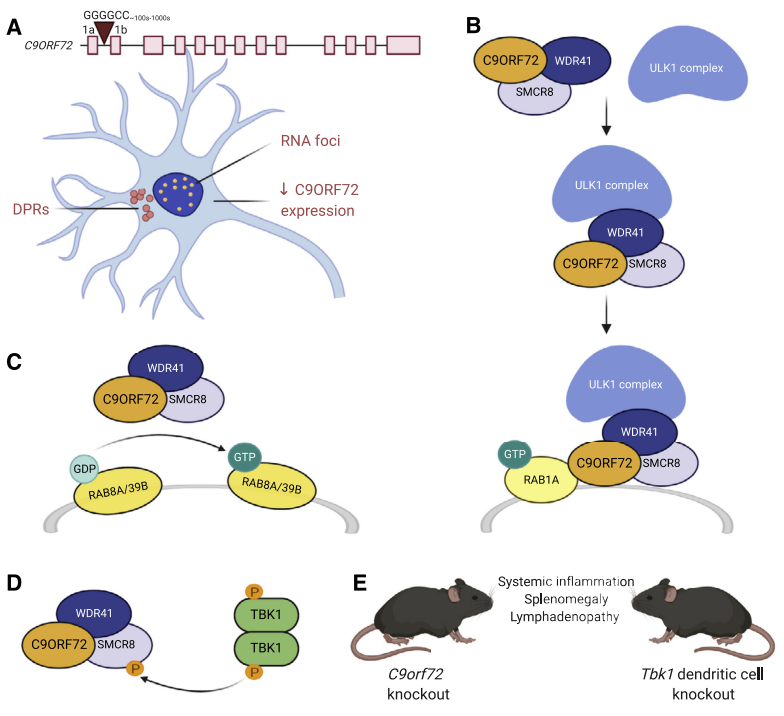
约5-10%的ALS患者具有家族遗传背景,主要以常染色体显性遗传。尽管遗传因素是ALS的关键原因,但只有60-70%的家族性ALS病因被明确。超过30个基因与ALS相关,其中C9ORF72、SOD1、TARDBP和FUS导致的病例占家族性ALS的70%。C9ORF72基因的GGGGCC重复扩增是ALS最常见的遗传原因,尤其在欧洲人群中占约34%的ALS病例。这种突变通过RNA毒性、二肽重复蛋白(DPR)毒性或C9ORF72功能不足导致疾病。C9ORF72参与自噬过程,与SMCR8和WDR41形成复合体,调控ULK1复合物及Rab GTP酶活性。其敲除可引起免疫系统失调,抑制STING信号通路可缓解症状。此外,C9ORF72还影响TFEB,进而调控自噬和溶酶体功能,对清除细胞内蛋白质聚集体至关重要。
五、氧化应激机制
氧化应激在ALS发病中起关键作用,表现为谷胱甘肽失衡、Nrf2及抗氧化反应失调。TDP-43异常聚集与ALS进展密切相关,氧化应激促进其乙酰化和磷酸化,影响RNA结合并加剧神经损伤。此外,氧化应激改变TDP-43和FUS的分布,干扰RNA加工,并通过星形胶质细胞上调半胱氨酸-谷氨酸反转运蛋白增加谷氨酸释放,增强对运动神经元的兴奋性毒性。这些过程共同导致线粒体功能障碍和进一步的氧化应激。
六、兴奋性毒性机制
在ALS中,突触后谷氨酸受体过度激活导致兴奋性毒性,增加胞内钙离子水平,引发神经元损伤。ALS模型显示,运动神经元特异性地表现出钙可渗透性AMPA受体增多和钙缓冲蛋白减少,增强了对兴奋性毒性的敏感性。C9orf72突变在人诱导多能干细胞中也增加了这种敏感性。调节代谢性谷氨酸受体以减少谷氨酸释放并促进神经营养因子生成,可能成为治疗ALS的新策略。
七、神经炎症反应机制
神经炎症是ALS的一个显著病理特征。研究显示,从ALS患者成纤维细胞诱导而来的星形胶质细胞与运动神经元共培养时,会表现出对神经元的毒性作用。小胶质细胞在神经系统中具有双重角色:M1型小胶质细胞促进炎症反应(神经毒性),而M2型则倾向于抗炎和保护神经(神经保护性)。在SOD1转基因ALS模型小鼠中观察到,原本具有保护功能的M2型小胶质细胞逐渐转变为促炎性的M1型。此外,ALS患者的外周血单核细胞更易于激活,并且倾向于分化为M1型小胶质细胞。NLRP3炎症小体的激活被认为是ALS中神经炎症的关键因素之一。抑制NLRP3炎症小体的活性可能通过减少由小胶质细胞激活所引起的神经炎症来改善ALS的症状,这为开发新的治疗策略提供了潜在方向。
八、线粒体功能紊乱机制
线粒体功能异常是ALS的关键病理机制,表现为能量代谢障碍、活性氧增加、轴突运输中断及结构动力学改变,最终导致细胞凋亡。SOD1突变聚集在线粒体膜间隙,降低电子传递链活性;C9orf72突变产生的poly-GR与ATP5A1结合,加速其泛素化和降解。TDP-43通过调控线粒体转录维持线粒体稳态。这些变化共同加剧了ALS中的线粒体功能障碍。
九、DNA和RNA损伤机制
ALS患者中枢神经系统中氧化型脱氧鸟苷水平升高,DNA受损,表现为无嘌呤/无嘧啶位点增加和DNA损伤反应(DDR)激活。TDP-43在DDR信号中起调控作用,其缺失与DDR相关。TDP-43参与非同源末端连接修复,TARDBP突变抑制该过程并导致DNA损伤。TDP-43缺失还增加R环形成和基因组不稳定性。FUS和NEK1突变也影响DNA修复。此外,C9orf72突变引起RNA累积,干扰RNA剪接等代谢过程,并导致核质转移受损,抑制TDP-43核输出可减少神经元死亡。
十、检测方式
ALS的临床表现个体间差异大,早期表现多样,缺少特异性生物学标志物,确诊较困难,通常需要综合多种检测方法,包括神经电生理检查(如神经传导测试和针电极肌电图)来评估神经和肌肉电活动,磁共振成像(MRI)以排除其他可能的疾病,血液和尿液检测以排除重金属中毒、自身免疫性疾病或维生素缺乏,脑脊液分析以排除感染或其他神经系统疾病,以及基因检测对于有家族史的患者确定遗传形式。在某些情况下,还可能进行肌肉和神经活检、肺功能测试、超声检查以及检测脑脊液和血清中的神经丝轻链水平,以全面评估病情并排除其他可能性。这些检测方法的结合使用有助于确保准确诊断。为了支持ALS疾病相关药物开发和检测,菲恩生物研发了一系列高质量的重组蛋白、抗体和ELISA试剂盒。这些产品包括高纯度、高活性且批间一致性高的重组蛋白,以及灵敏度高、检测效果优异的ELISA试剂盒。菲恩生物的产品广泛适用于免疫学研究、抗体筛选和候选药物的功能验证等多种应用,为科研人员提供了可靠的工具。
以下是为您推荐的相关产品
| 相关蛋白产品 | |||
| 货号 | 产品名称 | 分子量 | 表达体系 |
| P4367 | Recombinant Human SOD1 | 16.7 kDa | E.Coli |
| P2106 | Recombinant Human C9orf72 | 42.8 kDa | E.Coli |
| P5715 | Recombinant Human TARDBP | 28.5 kDa | E.Coli |
| 相关抗体产品 | |||
| 货号 | 产品名称 | 验证实验 | 抗体类型 |
| FNab08103 | SOD1 antibody | ELISA, WB, IHC, IP, IF | 兔多抗 |
| FNab01147 | C9orf72 antibody | ELISA, WB, IHC, IF, IP | 兔多抗 |
| FNab08577 | TARDBP antibody | ELISA, IP, FC, WB, IHC | 鼠单抗 |
| 相关ELISA试剂盒产品 | |||
| 货号 | 名称 | 检测范围 | 灵敏度 |
| EH0649 | Human SOD1 ELISA Kit | 0.781-50ng/ml (10000IU/mg) | 0.469ng/ml |
| EM0419 | Mouse SOD1 ELISA Kit | 0.781-50ng/ml | 0.469ng/ml |
| ER0332 | Rat SOD1 ELISA Kit | 0.781-50ng/ml | 0.469ng/ml |
| EH14546 | Human FUS ELISA Kit | 78.125-5000pg/ml | 46.875pg/ml |
| EM1394 | Mouse TDP43 ELISA Kit | 0.313-20ng/ml | 0.188ng/ml |
| QT-EH3862 | Human TDP43 QuickTest ELISA Kit | 0.313-20ng/ml | 0.188ng/ml |
| QT-EH4239 | Human NGFR QuickTest ELISA Kit | 1.563-100ng/ml | 0.938ng/ml |

 联系我们
CONTACT
联系我们
CONTACT